Tìm nguồn cung ứng, nhập khẩu vitamin A nói chung và vitamin A liều cao
Theo đó, Cục Quản lý Dược, Bộ Y tế nhận được Công văn số 3133/SYT-NVD đề ngày 27/4/2023 của Sở Y tế TP Hồ Chí Minh về việc thiếu nguồn cung ứng thuốc vitamin A đơn thành phần dược chất (gọi tắt là vitamin A) để sử dụng cho chương trình y tế.
Trước đây, vitamin A liều cao (hàm lượng 100.000 IU và 200.000 IU) dùng để bổ sung cho trẻ từ 6 đến 60 tháng tuổi theo Quyết định số 3893/QĐ-BYT ngày 11/10/2007 của Bộ Y tế được các tổ chức nước ngoài viện trợ, nhập khẩu vào Việt Nam và phân bổ cho các tỉnh/TP trực thuộc Trung ương theo nhu cầu.
Theo Công văn số 1810/BYT-KH-TH ngày 03/04/2023 của Bộ Y tế về việc triển khai các nhiệm vụ thuộc Chương trình mục tiêu Y tế - Dân số chuyển thành nhiệm vụ chi thường xuyên. Và Công văn số 389/VDD-KHTH ngày 18/04/2023 của Viện Dinh dưỡng về việc chủ động bố trí nguồn kinh phí mua sắm vitamin A liều cao cấp cho trẻ em và phụ nữa sau sinh.
Từ năm 2023, các tỉnh/TP trực thuộc Trung ương phải chủ động xây dựng kế hoạch mua sắm vitamin A từ nguồn kinh phí của địa phương hoặc từ nguồn của các Chương trình Mục tiêu quốc gia đã được phân bổ cho địa phương.
Hiện nay, chỉ có 3 thuốc vitamin A (hàm lượng 5.000 IU) có Giấy đăng ký lưu hành còn hiệu lực tại Việt Nam.
Để đảm bảo nguồn cung ứng thuốc vitamin A nói chung và Vitamin A liều cao nói riêng, Cục Quản lý Dược đề nghị các cơ sở sản xuất thuốc, cơ sở nhập khẩu thuốc tăng cường nghiên cứu, sản xuất, tìm nguồn cung ứng và nhập khẩu thuốc vitamin A nói chung và vitamin A liều cao (hàm lượng 100.000 IU và 200.000 IU) để cung ứng cho chương trình y tế.
Trong quá trình thực hiện nếu có khó khăn, vướng mắc đề nghị các cơ sở báo cáo kịp thời về Cục Quản lý Dược để xem xét, giải quyết theo quy định.

Hà Nội thu hồi thuốc PMRemem giảm di chứng tai biến không đạt chất lượng
Kinhtedothi - Sở Y tế Hà Nội đã có Công văn số 2001/SYT-NVD về việc thu hồi thuốc PMRemem không đạt tiêu chuẩn chất lượng.
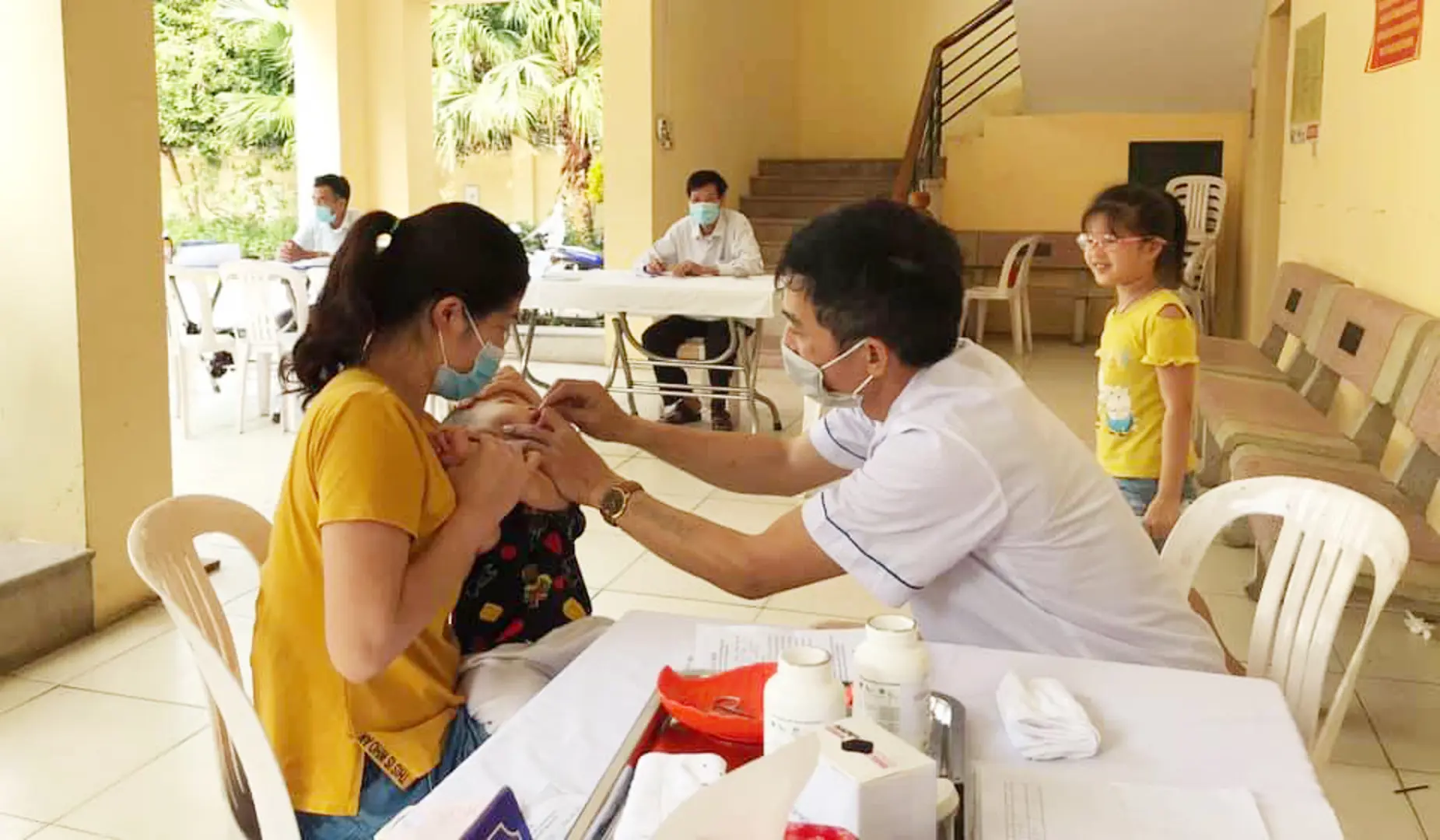
Hà Nội phấn đấu 99,8% trẻ từ 6 đến dưới 36 tháng tuổi uống vitamin A
Kinhtedothi - Hà Nội phấn đấu đảm bảo 99,8% trẻ em từ 6 tháng tuổi đến dưới 36 tháng tuổi được uống vitamin A liều cao trong 2 ngày 1 và 2/12/2022 (uống vét từ ngày 3-4/12/2022).
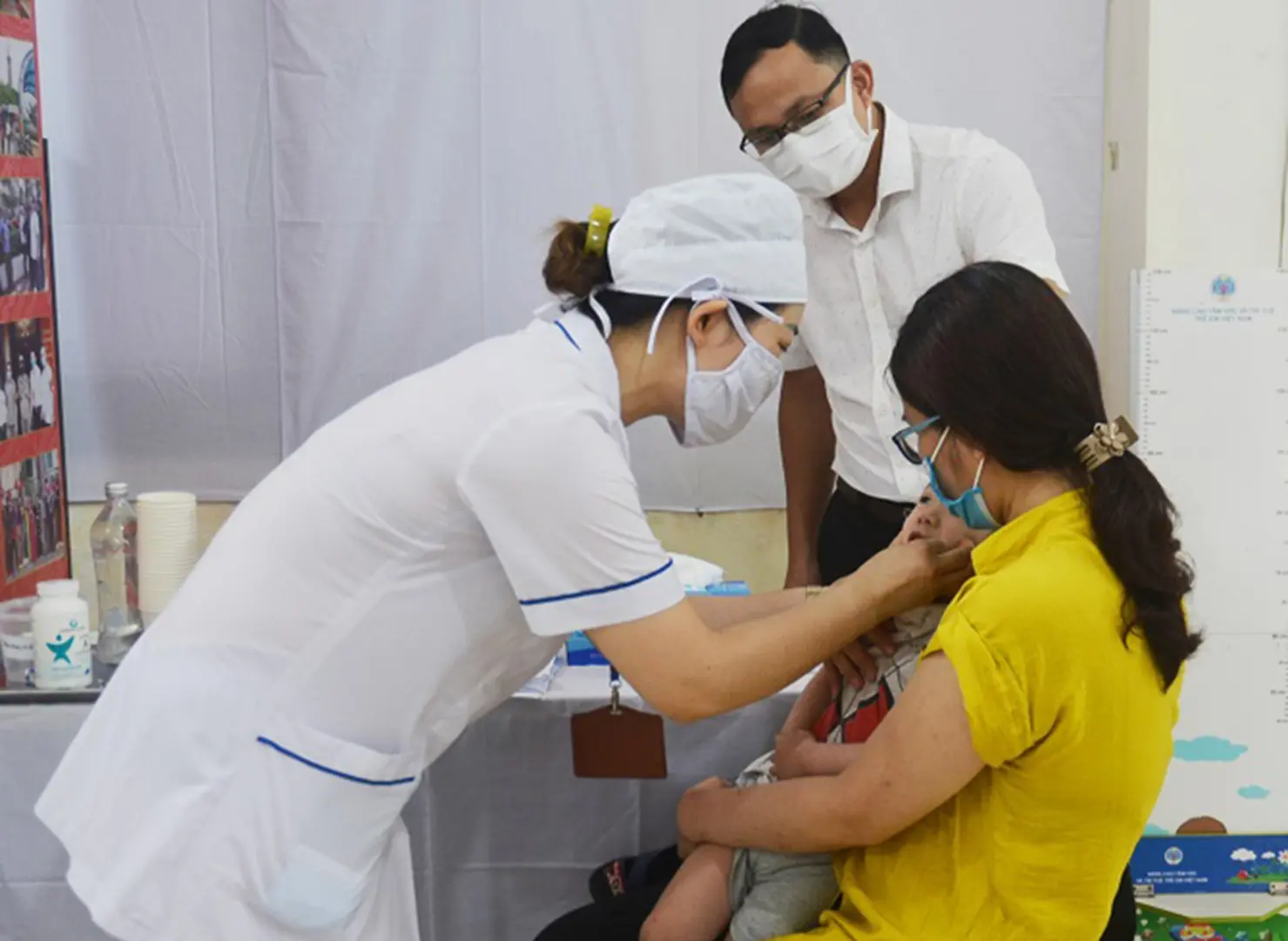
Hà Nội triển khai chiến dịch uống bổ sung Vitamin A cho trẻ
Kinhtedothi - Sở Y tế Hà Nội yêu cầu Trung tâm Kiểm soát bệnh tật (CDC) Hà Nội thường trực lập kế hoạch cụ thể, tổ chức Chiến dịch uống bổ sung Vitamin A cho trẻ từ 6-36 tháng tuổi theo hướng dẫn của Bộ Y tế, thời gian bắt đầu từ ngày 1/12/2022.






