Ngày 14/10, FDA thông báo cuộc thảo luận trên sẽ được tổ chức ngày 30/11 để rà soát các dữ liệu liên quan tới mức độ an toàn và hiệu quả của Molnupiravir, thuốc kháng virus SARS-CoV2 dạng uống của công ty dược phẩm Mỹ Merck.
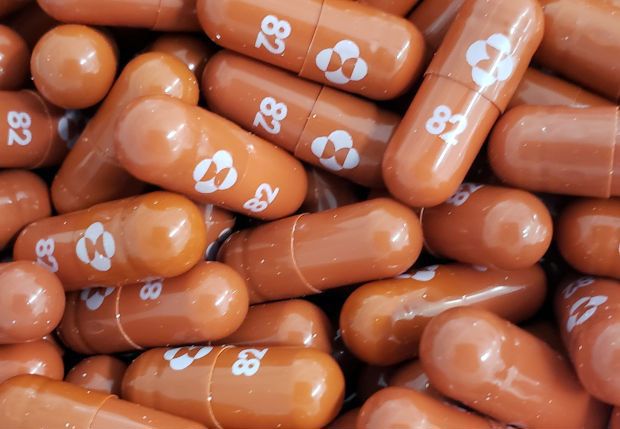
Trước đó, Merck đã đăng ký xin cấp phép sử dụng khẩn cấp cho loại thuốc này hồi đầu tuần, sau khi kết quả thử nghiệm cho thấy loại thuốc này có khả năng giảm nguy cơ nhập viện 50%.
Nếu được phê duyệt, thuốc viên Molnupiravir sẽ được chỉ định cho người trưởng thành mới xét nghiệm dương tính với Covid-19 và có nguy cơ mắc bệnh nặng, nhập viện hoặc tử vong.
Được biết, hãng dược phẩm Mỹ Pfizer và nhà sản xuất dược phẩm Thụy Sĩ Roche Holding AG cũng đang tăng tốc phát triển một loại thuốc viên điều trị Covid-19.
Chính phủ Mỹ đã đồng ý bỏ ra 1,2 tỷ đô la cho 1,7 triệu đợt điều trị sử dụng thuốc Molnupiravir với giá 700 USD/1 đợt điều trị, nếu được Cục Quản lý Thực phẩm và Dược phẩm Mỹ cấp phép sử dụng khẩn cấp. Công ty Merck cũng đã ký hợp đồng cung cấp thuốc này cho Malaysia và Singapore./.



![[Ảnh] Tổng Bí thư Tô Lâm làm việc với Ban Thường vụ Thành ủy Hà Nội [Ảnh] Tổng Bí thư Tô Lâm làm việc với Ban Thường vụ Thành ủy Hà Nội](https://static.kinhtedothi.vn/200x113/images/upload//2024/11/275eb58461-f5ad-422b-a912-1db683083952.jpg)








