Đây là danh sách các sản phẩm không được chấp nhận theo quy trình đánh giá sử dụng khẩn cấp với lưu ý các hồ sơ đã được đánh giá không cung cấp được bằng chứng, tài liệu cần thiết về an toàn, hiệu quả, theo hệ thống quản lý chất lượng (QMS) của WHO.
| Ảnh chụp màn hình Danh sách vật phẩm liên quan đến SARS-CoV2 không đủ tiêu chuẩn theo EUL của WHO cập nhật ngày 10/12. |
Trước đó, vào cuối tháng 4/2020, thông tin từ một cuộc họp báo do Bộ Khoa học - Công nghệ tổ chức cho biết, bộ kit xét nghiệm Covid-19 LightPower iVA SARS-CoV-2 1st RT-rPCR KIT do Công ty Cổ phần Công nghệ Việt Á sản xuất đã được Tổ chức Y tế Thế giới (WHO) chấp thuận. Sản phẩm được đánh giá theo Quy trình Danh sách Sử dụng Khẩn cấp (EUL) và cấp mã số EUL 0524-210-00.
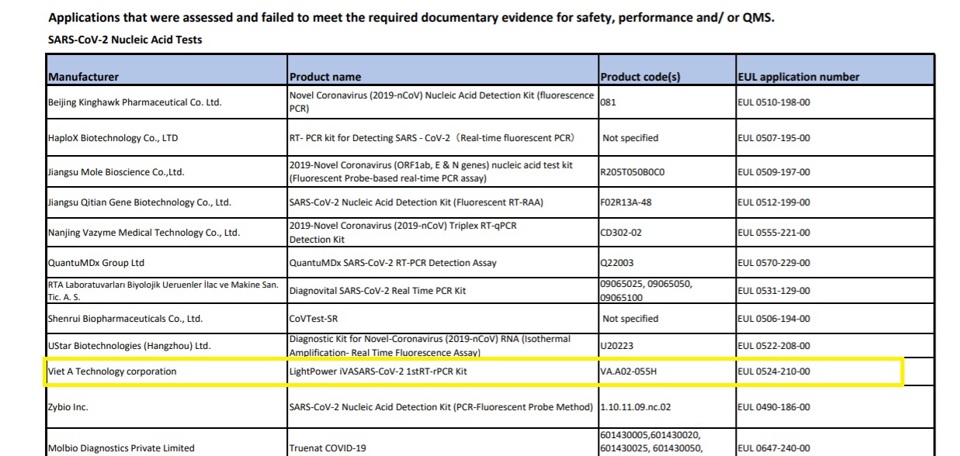
Tuy nhiên, một báo cáo về đánh giá sử dụng khẩn cấp của WHO ngày 20/10/2020 cho thấy, kết quả thẩm định của tổ chức này với bộ xét nghiệm COVID-19 của Việt Á là: Not Accepted - Không được chấp nhận.
| Báo cáo của WHO công bố vào tháng 10/2020 cho thấy bộ kit xét nghiệm của công ty Việt Á không được chấp thuận vào danh sách mua sắm của tổ chức này. Ảnh chụp màn hình website WHO. |
Báo cáo của WHO nêu rõ, bộ xét nghiệm LightPower iVASARS-CoV-2 1stRT-rPCR Kit với mã sản phẩm VA.A02-055H, sản xuất bởi Công ty cổ phần công nghệ Việt Á, địa chỉ 372A/8 Hồ Văn Huê, phường 9, quận Phú Nhuận, TP.HCM không đủ điều kiện để vào chương trình mua sắm của WHO.
Theo báo cáo này, để sản phẩm kit xét nghiệm Covid-19 trên đủ điều kiện để WHO chấp thuận, công ty Công nghệ Việt Á cần phải cung cấp thêm thông tin về tình trạng của hệ thống quản lý chất lượng của họ.
Quy trình liệt kê sử dụng khẩn cấp (EUL) được WHO đưa ra trong bối cảnh đại dịch Covid-19 kéo dài 2 năm qua. Quy trình này nhằm đánh giá tính phù hợp của các sản phẩm y tế mới trong các trường hợp khẩn cấp về sức khỏe cộng đồng.
Mục tiêu là cung cấp thuốc, vaccine và chẩn đoán nhanh nhất có thể để giải quyết tình trạng khẩn cấp đồng thời tuân thủ các tiêu chí nghiêm ngặt về an toàn, hiệu quả và chất lượng. Đánh giá cân nhắc mối đe dọa do trường hợp khẩn cấp gây ra cũng như lợi ích tích lũy từ việc sử dụng sản phẩm trước mọi rủi ro tiềm ẩn.
EUL nhằm hỗ trợ thông tin cho các cơ quan mua sắm và các nước thành viên Liên Hợp quốc.




![[Ảnh] Tổng Bí thư Tô Lâm làm việc với Ban Thường vụ Thành ủy Hà Nội [Ảnh] Tổng Bí thư Tô Lâm làm việc với Ban Thường vụ Thành ủy Hà Nội](https://static.kinhtedothi.vn/200x113/images/upload//2024/11/275eb58461-f5ad-422b-a912-1db683083952.jpg)








